化学实验现象与反应方程式整理
钠在空气中燃烧时,会产生黄色火焰并生成淡黄色固体。反应方程式为2Na + O2 → Na2O2。
当钠块暴露在空气中时,表面会迅速变暗。这个过程的化学方程式可以表示为4Na + O2 = 2Na2O。
钠在氯气中燃烧会产生黄色火焰,同时生成白色固体。反应方程式写作2Na + Cl2 → 2NaCl。

将钠与硫粉混合研磨会发生爆炸反应,方程式为2Na + S = Na2S。
钠与水反应时现象非常剧烈,钠会熔化成银白色小球,在水面四处游动。离子方程式为2Na + 2H2O = 2Na+ + 2OH- + H2↑。
过氧化钠与水反应会放出热量,淡黄色固体逐渐变白。离子方程式是2Na2O2 + 2H2O = 4Na+ + 4OH- + O2↑。
过氧化钠与二氧化碳反应的现象与和水反应类似,方程式为2Na2O2 + 2CO2 = 2Na2CO3 + O2。
在纯碱溶液中逐滴加入盐酸时,开始没有气泡,过量后会出现气泡。离子方程式分两步:CO32- + H+ = HCO3-;HCO3- + H+ = H2O + CO2↑。
大理石中加入盐酸会立即产生气体,方程式为CaCO3 + 2H+ = H2O + CO2↑ + Ca2+。
石灰水中通入二氧化碳时,先产生白色沉淀,过量后沉淀消失。相关方程式为CO2 + Ca2+ + 2OH- = CaCO3↓ + H2O;CaCO3 + H2O + CO2 = Ca2+ + 2HCO3-。
盐酸中滴加纯碱溶液会立即产生气泡,离子方程式为CO32- + 2H+ = H2O + CO2↑。
氢氧化钠溶液滴入饱和碳酸氢钠溶液时无明显现象,离子方程式为HCO3- + OH- = H2O + CO32-。
氢氧化钠溶液中通入过量二氧化碳会有晶体析出,相关方程式为CO2 + 2OH- = CO32- + H2O;CO32- + H2O + CO2 = 2HCO3-。
小苏打受热分解会产生使澄清石灰水变浑浊的气体,方程式为2NaHCO3 → Na2CO3 + H2O + CO2↑。
镁条投入沸水中会使含酚酞的水变红,反应方程式为Mg + 2H2O(热水) = Mg(OH)2 + H2↑。
铝片与稀盐酸反应片刻后会产生气泡,相关方程式包括Al2O3 + 6H+ = 2Al3+ + 3H2O和2Al + 6H+ = 2Al3+ + 3H2↑。
铝与氢氧化钠溶液反应也会产生气泡,离子方程式为Al2O3 + 2OH- = 2AlO2- + H2O和2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑。
氧化铝溶于盐酸的离子方程式为Al2O3 + 6H+ = 2Al3+ + 3H2O。
氧化铝溶于氢氧化钠溶液的离子方程式为Al2O3 + 2OH- = 2AlO2- + H2O。
硫酸铝溶液中滴加过量氨水会产生白色絮状沉淀,离子方程式为Al3+ + 3NH3·H2O = Al(OH)3↓ + 3NH4+。
氢氧化铝与盐酸反应会使白色固体溶解,离子方程式为Al(OH)3 + 3H+ = Al3+ + 3H2O。
氢氧化铝与氢氧化钠溶液反应也会使白色固体溶解,离子方程式为Al(OH)3 + OH- = AlO2- + 2H2O。
加热氢氧化铝会使其分解,方程式为2Al(OH)3 → Al2O3 + 3H2O。
铁在氯气中燃烧会产生棕褐色烟,溶于水后形成黄色溶液。反应方程式为2Fe + 3Cl2 → 2FeCl3。
铜丝在氯气中燃烧会产生棕黄色烟,溶于水形成蓝色溶液。方程式为Cu + Cl2 → CuCl2。
铁与水蒸气反应会产生气体,点燃时呈现淡蓝色火焰。方程式为3Fe + 4H2O(g) → Fe3O4 + 4H2。
氯化铁溶液中滴入氢氧化钠会产生红褐色沉淀,离子方程式为Fe3+ + 3OH- = Fe(OH)3↓。
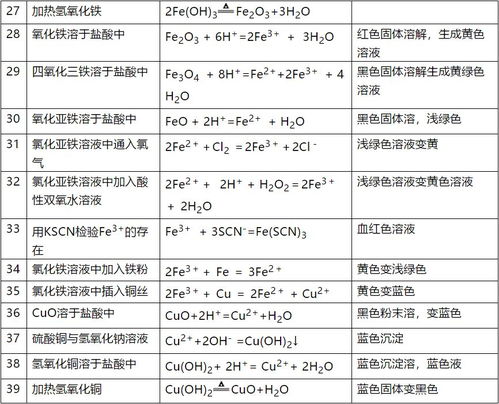
氢氧化亚铁在空气中会逐渐由白色变为灰绿色,最终成为红褐色。方程式为4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3。
加热氢氧化铁会使其分解,方程式为2Fe(OH)3 → Fe2O3 + 3H2O。
氧化铁溶于盐酸时红色固体会溶解,形成黄色溶液。离子方程式为Fe2O3 + 6H+ = 2Fe3+ + 3H2O。

四氧化三铁溶于盐酸时黑色固体会溶解,形成黄绿色溶液。离子方程式为Fe3O4 + 8H+ = Fe2+ + 2Fe3+ + 4H2O。
氧化亚铁溶于盐酸时黑色固体会溶解,形成浅绿色溶液。离子方程式为FeO + 2H+ = Fe2+ + H2O。
氯化亚铁溶液中通入氯气会使浅绿色溶液变黄,离子方程式为2Fe2+ + Cl2 = 2Fe3+ + 2Cl-。

氯化亚铁溶液中加入酸性双氧水也会使浅绿色溶液变黄,离子方程式为2Fe2+ + 2H+ + H2O2 = 2Fe3+ + 2H2O。
用KSCN检验Fe3+会产生血红色溶液,离子方程式为Fe3+ + 3SCN- = Fe(SCN)3。
氯化铁溶液中加入铁粉会使黄色溶液变浅绿色,离子方程式为2Fe3+ + Fe = 3Fe2+。
氯化铁溶液中插入铜丝会使黄色溶液变蓝色,离子方程式为2Fe3+ + Cu = 2Fe2+ + Cu2+。
氧化铜溶于盐酸时黑色粉末会溶解,形成蓝色溶液。离子方程式为CuO + 2H+ = Cu2+ + H2O。
硫酸铜与氢氧化钠溶液反应会产生蓝色沉淀,离子方程式为Cu2+ + 2OH- = Cu(OH)2↓。
氢氧化铜溶于盐酸时蓝色沉淀会溶解,形成蓝色溶液。离子方程式为Cu(OH)2 + 2H+ = Cu2+ + 2H2O。
加热氢氧化铜会使蓝色固体变黑,方程式为Cu(OH)2 → CuO + H2O。
钠投入硫酸铜溶液时反应剧烈,钠熔化成银白色小球在水面游动,同时产生蓝色絮状沉淀。离子方程式为2Na + 2H2O + Cu2+ = Cu(OH)2↓ + 2Na+ + H2↑。
偏铝酸钠溶液中逐滴加入盐酸时,先产生白色沉淀后又溶解。相关离子方程式为AlO2- + H+ + H2O = Al(OH)3↓和Al(OH)3 + 3H+ = Al3+ + 3H2O。
偏铝酸钠溶液中通入过量二氧化碳会产生不溶的白色沉淀,离子方程式为AlO2- + CO2 + 2H2O = Al(OH)3↓ + HCO3-。
氯化铝溶液中逐滴加入氢氧化钠时,先产生白色沉淀后又溶解。相关离子方程式为Al3+ + 3OH- = Al(OH)3↓和Al(OH)3 + OH- = AlO2- + 2H2O。
Al3+与AlO2-溶液混合会产生白色絮状沉淀,离子方程式为Al3+ + 3AlO2- + 6H2O = 4Al(OH)3↓。
氧化亚铁溶于稀硝酸会产生气体,黑色固体溶解形成黄色溶液。离子方程式为3FeO + 10H+ + NO3- = 3Fe3+ + NO↑ + 5H2O。
四氧化三铁溶于氢碘酸时黑色固体会溶解,形成棕红色溶液。离子方程式为Fe3O4 + 8H+ + 2I- = 3Fe2+ + I2 + 4H2O。
酸性高锰酸钾溶液中加入氯化亚铁溶液会使紫色褪去,变为浅黄色。离子方程式为5Fe2+ + MnO4- + 8H+ = 5Fe3+ + Mn2+ + 4H2O。
氯化亚铁溶液中加入稀硝酸会产生气体,浅绿色溶液变黄。离子方程式为3Fe2+ + 4H+ + NO3- = 3Fe3+ + NO↑ + 2H2O。
氯化铁溶液中加入碘化钾会使黄色溶液变棕色,离子方程式为2Fe3+ + 2I- = 2Fe2+ + I2。
明矾溶液中滴加氢氧化钡至硫酸根完全沉淀时会产生白色沉淀,离子方程式为Al3+ + 2SO42- + 2Ba2+ + 4OH- = 2BaSO4↓ + AlO2- + 2H2O。
明矾溶液中滴加氢氧化钡至铝离子完全沉淀时也会产生白色沉淀,离子方程式为2Al3+ + 3SO42- + 3Ba2+ + 6OH- = 3BaSO4↓ + 2Al(OH)3↓。
向氯化亚铁溶液中加入过氧化钠固体时会产生无色气体,同时生成红褐色沉淀。相关离子方程式为2Na2O2 + 2H2O = 4Na+ + 4OH- + O2↑和4Fe2+ + O2 + 8OH- + 2H2O = 4Fe(OH)3↓。